加齢の影響を受けやすいサルコペニア。
ただし、高齢者でなくても生じる可能性がある
サルコペニアは、転倒・骨折、身体機能の低下、嚥下障害、認知機能の低下、死亡などの健康障害のリスクが高まった、進行性かつ全身性の骨格筋疾患です。
サルコペニアは、骨格筋量の減少、筋力の低下、身体機能の低下を組み合わせて診断することで、将来的な健康障害の予測として優れていることが明らかになってきています。
実際に、アジアや欧州のワーキンググループが提言している診断アルゴリズムでも、この考え方が主流となっています。
ほかの原因が明らかでない場合のサルコペニアは“一次性(または加齢性)”と考えられ、加齢以外の(または加齢に加えて)原因が明らかな場合は、“二次性”と考えられます。
疾患、低活動、低栄養が原因のサルコペニアは、高齢者でなくても生じる可能性があり、臨床的に有用な考え方です。
疫学的には、65歳以上の地域高齢者の8~10%がサルコペニアに罹患していると考えられています。
急性期病院での約11日間の入院中に、14.7%の高齢者がサルコペニアを新規発症することが報告されています[1]。
いっぽう、回復期リハビリテーション病棟では、入院患者の約50%がサルコペニアに罹患していると報告されており、サルコペニアを合併するとADL(日常生活動作=食事や排せつ、着替え、移動など、日常動作を送るために必要な動作のこと)や嚥下障害の改善、自宅退院に対して、負の関連があることが指摘されています[2]。
スポンサーリンク
診断には、ふくらはぎの太さの計測や、さまざまなテストが用いられる
サルコペニアの診断は、Asian Working Group for Sarcopenia 2019 (AWGS2019)という、前述したワーキンググループの診断アルゴリズムに沿って行います(図1)[3]。
AWGS2019では、「症例の抽出」→「評価」→「診断」→「治療」という一連のアルゴリズムを提唱しており、骨格筋量が評価できない環境においても、「サルコペニアの可能性」という判定をもとに、治療を行うことができるようになりました。
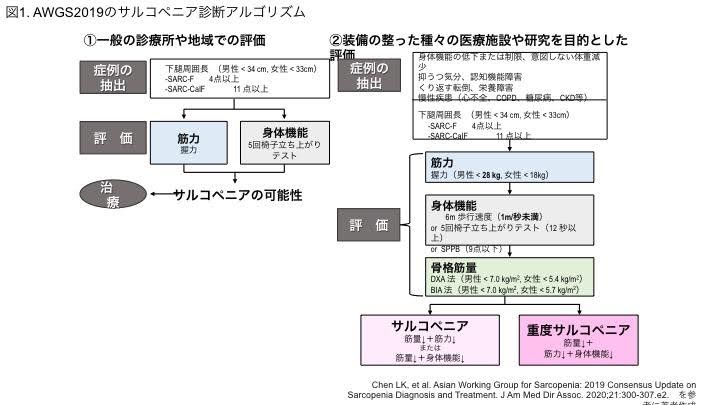
症例の抽出方法としては、下腿周囲長“かたいしゅういちょう”(ふくらはぎのもっとも太い部分の長さ)や、SARC-F、SARC-Calfといって、スクリーニングツールの使用を推奨しています。
医療機関や研究施設では、これらに加えて身体機能の低下、意図しない体重減少、抑うつや認知レベルの低下、くり返す転倒、低栄養、慢性疾患の合併を症例抽出の項目として明記しています。
「筋力」の評価方法は、握力測定が推奨されています。握力は全身の筋力を反映しているからです。
「身体機能」の評価には、5回椅子立ち上がりテスト(椅子から立ち上がる動作を5回くり返し、それにかかる時間を測るもの)や歩行速度のほか、バランステスト・歩行テスト・立ち上がりテストという3つのテストからなるShort Physical Performance Battery (SPPB)が推奨されています。
スポンサーリンク
サルコペニアと低栄養が、フレイルを引き起こす主な要因に
フレイルは、加齢に伴いさまざまな臓器の機能変化や予備能力の低下が生じ、外的ストレスに対する脆弱“ぜいじゃく”性が亢進“こうしん”した状態です。
QOL(生活の質)を落とすだけでなく、ADLの低下や、転倒・骨折、独居困難、合併症の増悪、入院、施設入所、死亡などの有害事象が生じやすいといえます。
フレイルには「身体的フレイル」「認知的フレイル」「社会的フレイル」「オーラルフレイル」などがあります。
身体的フレイルには、加齢による骨格筋量の減少や、食思不振による慢性的な低栄養などが相互に影響しています(フレイルの発生サイクル)。
多くの要因の中でも、“サルコペニア”と“低栄養”が身体的フレイルの中核要因であるといえます。
地域在住高齢者だけでなく、急性期病院や回復期リハビリテーション病棟においてもフレイルを評価し、適切な予防や治療などの対策を行うことが重要です。
フレイルの評価にはさまざまなものがありますが、現在、世界的にもっともよく使用される診断は、Friedらの提唱した「the Cardiovascular Health. Study:CHS基準」です。
改訂日本版CHS基準(改訂J-CHS基準)では、①体重減少、②筋力低下、③疲労感、④歩行速度、⑤身体活動を用いて評価します(表1)[4]。

厚生労働省は2020年4月より、75歳以上の後期高齢者を対象に、フレイルに特化した健診を開始しました(フレイル健診)。
健診では10種類15項目の問診と、フレイルのスクリーニングを行い、フレイルの予防や治療を早期に行うことを目的としています。
サルコペニアもフレイルも、運動療法+栄養療法が予防・治療の中心となる
サルコペニアや(身体的)フレイルに対する治療においては、現時点では、治療効果が十分に検証された薬剤は存在しません。
サルコペニアの予防としては、スクワットや腕立て伏せなど、筋肉に抵抗(レジスタンス)をかける動作を繰り返す「レジスタンス運動」を含む“運動療法”や、“活動的な生活”に加えて、“バランスのよい栄養摂取”が推奨されています。
栄養面では、とくに十分なたんぱく質の摂取が勧められます。
治療も同様に、運動療法と栄養療法の併用が推奨されており、栄養療法としては、必須アミノ酸の強化が挙げられています(図2)[5]。

いっぽう、フレイルの診療ガイドラインでは、「意図しない体重減少を呈したフレイル高齢者には、食物の栄養価の強化、たんぱく質やエネルギー補給を考慮する」と、栄養療法が条件付きで推奨されています。
フレイル診療ガイド2018年度版では、「栄養教育、栄養補助食品による単独介入の効果を弱く推奨する」とされています[6]。
栄養面でとくに重要なのはたんぱく質。“量”も“質”も意識する
体重やBMIではなく、骨格筋量そのものが、より高齢者の予後を規定していることも判明しています。
そのため、本質的に重要なのは体重の維持ではなく、骨格筋量の維持や増量です。
骨格筋量を維持するためには、高齢者は若年者より多くのたんぱく質の摂取が必要となります。
厚生労働省の「日本人の食事摂取基準(2020年版)」では、高齢者のためのサルコペニア・フレイル予防を目的とするたんぱく質の摂取量として、大まかに体重1kgあたり、1日に1.5g程度のたんぱく質の摂取を推奨しています。
“量”とともに、摂取するたんぱく質の“質”も考慮する必要があります。
良質なたんぱく質、たとえば分岐鎖アミノ酸(バリン、ロイシン、イソロイシン)などの必須アミノ酸を選択的に多く摂取することで、より少ないたんぱく質の摂取量で、骨格筋の減少を抑制できる可能性があるのです。
回復期リハビリテーション病棟において、サルコペニアを有する脳卒中の患者を対象に行ったランダム化比較試験では、ロイシン高濃度含有アミノ酸サプリメントを投与したうえで負荷の少ないレジスタンストレーニングを施行すると、アミノ酸を投与せずにトレーニングだけを行った群と比べて、 ADLが有意により大きく改善することが示されています[7]。
また、サルコペニアやフレイルの患者に対する栄養療法では、口腔機能や嚥下機能の評価を同時に行うべきです。
口腔機能障害や嚥下障害を認める場合は、多職種でのアプローチが望ましいといえます。
歯科職種との医科歯科連携も大切です。
薬物療法も重要です。
薬物関連の問題にはポリファーマシー(「多剤内服」ともいいます。本邦では6種類以上の薬を内服している状態を指すことが多いです)、潜在的不適切薬物(PIMs)(高齢者にとって効果よりも有害事象や副作用のほうがより懸念される薬剤のことをいいます)、処方漏れ(PPOs)の可能性、抗コリン作用負荷(抗コリン作用を有する薬剤により生じる好ましくない影響があり、記憶力の低下や口渇、視力の低下、便秘などの副作用が生じることがあります)などがあります[8]。
これらは嚥下障害、うつ病、眠気、転倒・骨折、失禁、食欲低下、パーキンソン症候群などの薬物有害事象と関連し、ADL、QOL、栄養状態の改善を阻害してしまいます。
サルコペニア高齢者のポリファーマシーの是正で、栄養摂取量が改善したことが近年報告されています[9]。
いかがでしたでしょうか。
まずは食事面の見直しから、サルコペニア、ひいてはフレイルの予防に取り組んでいきましょう。
【引用文献】
[1]Martone AM, et al. The incidence of sarcopenia among hospitalized older patients: results from the Glisten study. J Cachexia Sarcopenia Muscle. 2017;8:907-914.
[2]Yoshimura Y, et al. Sarcopenia is associated with worse recovery of physical function and dysphagia and a lower rate of home discharge in Japanese hospitalized adults undergoing convalescent rehabilitation. Nutrition. 2019;61:111-118.
[3]Chen LK, et al. Asian Working Group for Sarcopenia: 2019 Consensus Update on Sarcopenia Diagnosis and Treatment. J Am Med Dir Assoc. 2020 Mar;21(3):300-307.e2. doi: 10.1016/j.jamda.2019.12.012.
[4]Satake S, et al. The revised Japanese version of the Cardiovascular Health Study criteria (revised J-CHS criteria). Geriatr Gerontol Int. 2020;20:992-993.
[5]サルコペニア診療ガイドライン作成委員会. サルコペニア診療ガイドライン2017年度版一部改訂. ライフサイエンス出版, 2020.
[6]Dent E, et al: The Asia-Pacific clinical practice guidelines for the management of frailty. J Am Med Dir Assoc 2017; 18 (7): 564-575.
[7]Yoshimura Y, et al. Effects of a leucine-enriched amino acid supplement on muscle mass, muscle strength, and physical function in post-stroke patients with sarcopenia: A randomized controlled trial. Nutrition. 2019;58:1-6.
[8]Matsumoto A, et al. Polypharmacy and potentially inappropriate medications in stroke rehabilitation: prevalence and association with outcomes. Int J Clin Pharm. 2022 May 16.
[9]Matsumoto A, et al. Deprescribing Leads to Improved Energy Intake among Hospitalized Older Sarcopenic Adults with Polypharmacy after Stroke. Nutrients. 2022 Jan 19;14(3):443.
熊本リハビリテーション病院 サルコペニア・低栄養研究センター長
吉村芳弘 先生